
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
โบซูตินิบ CAS 380843-75-4
2023-08-21
ชื่อทางเคมี:
4-(2,4-ไดคลอโร-5-เมทอกซีอานิลิโน)-6-เมทอกซี-7-[3-(4-เมทิลไพเพอราซิน-1-อิล)โพรพอกซี]ควิโนลีน-3-คาร์โบไนไทรล์
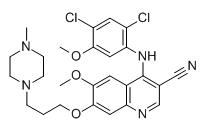
MF:C26H29Cl2N5O3
คุณสมบัติทางเคมี :ของแข็งสีเหลืองอ่อน
Bosutinib เป็นตัวยับยั้งไคเนส Bcr-Abl สำหรับการรักษามะเร็งเม็ดเลือดขาวเรื้อรังชนิดไมอิลอยด์ (CML) ในฟิลาเดลเฟีย เมื่อเปรียบเทียบกับสารยับยั้งไทโรซีนไคเนสชนิดอื่นๆ มันมีความเป็นพิษต่อระบบโลหิตวิทยาที่ดีกว่า อย.อนุมัติเมื่อ 4 กันยายน 2555
ผู้ริเริ่ม:ไวเอท ฟาร์มาซูติคอล (ไฟเซอร์) (สหรัฐอเมริกา)
การใช้งาน:
ผลต่อสัณฐานวิทยาของเซลล์ถูกสังเกตที่ความเข้มข้น 1 µM SKI-606 สำหรับสายพันธุ์ของเซลล์ทั้งหมดที่ตรวจสอบ และการเปลี่ยนแปลงทางสัณฐานวิทยาปรากฏชัดเจนที่ความเข้มข้นต่ำเท่ากับ 0.25 µM SKI-606 ทำให้เซลล์เกาะติดกัน ก่อตัวเป็นกระจุกหนาแน่นเมื่อเปรียบเทียบกับเซลล์ที่ได้รับการควบคุมด้วยยานพาหนะ (DMSO) ซึ่งแสดงการแพร่กระจายไปทั่วพื้นที่ขนาดใหญ่
รูปแบบการให้ยา: การบริหารช่องปาก 100 มก./กก./วัน เป็นเวลา 28 วัน
ตัวกลาง:
CAS เลขที่ 2031-23-4 1-(3-คลอโรโพรพิล)-4-เมทิลไพเพอราซีน ไดไฮโดรคลอไรด์
CAS เลขที่ 214470-66-3 7-(3-คลอโรโพรพอกซี)-4-ไฮดรอกซี-6-เมทอกซีควิโนลีน-3-คาร์โบไนไตรล์
CAS เลขที่ 214470-68-5 4-CHLORO-7-(3-CHLORO-PROPOXY)-6-METHOXY-QUINOLINE-3-CARBONITRILE
CAS เลขที่ 263149-10-6 4-คลอโร-7-ไฮดรอกซี-6-เมโธซี-ควิโนลีน-3-คาร์โบไนไตรล์
CAS เลขที่ 380844-49-5 7-(3-คลอโร-โพรพอกซี)-4-(2,4-ไดคลอโร-5-เมโธซี-ฟีนิลลามิโน)-6-เมโธซี-ควิโนลีน-3-คาร์โบไนไตรล์
ยาเป้าหมาย Bsutinib (Bosulif) ได้รับการอนุมัติจากสำนักงานคณะกรรมการอาหารและยา (FDA) เพื่อใช้รักษาโรคมะเร็งเม็ดเลือดขาวชนิดเรื้อรังแบบไมอิลอยด์ Besutinib เป็นตัวยับยั้งไคเนสที่ยับยั้งเส้นทางการส่งสัญญาณของ Abl และ Src ยานี้มีจุดมุ่งหมายเพื่อรักษาผู้ป่วยผู้ใหญ่ CML ที่มีโครโมโซมบวก (Ph+) ในฟิลาเดลเฟียแบบเรื้อรัง แบบเร่ง หรือแบบเฉียบพลัน ซึ่งมีการดื้อยาหรือการแพ้ยาก่อนหน้านี้ ตามประกาศของ Pfizer Oncology ประมาณหนึ่งในสามของผู้ป่วย CML ไม่ตอบสนองต่อการรักษาด้วยยามาตรฐานบรรทัดแรก Gleevec ไฟเซอร์กล่าว ประมาณครึ่งหนึ่งของผู้ป่วยที่เกิดการดื้อหรือแพ้ยาอิมาตินิบก็ตอบสนองได้ไม่ดีต่อสารยับยั้งไทโรซีนไคเนสบรรทัดที่สอง (TKI) อื่น ๆ บริษัท กล่าว
การอนุมัติยารับประทานนั้นขึ้นอยู่กับการทดลองทางคลินิกระยะที่ 1 และระยะที่ 2 ที่เกี่ยวข้องกับผู้ป่วย CML ที่ให้ผลบวกของค่า PH จำนวน 500 ราย ซึ่งไม่ตอบสนองหรือไม่ทนต่อยาอิมาตินิบ ซึ่งรวมถึงกลุ่มต่างๆ ในระยะเรื้อรัง ระยะเร่งด่วน และระยะเฉียบพลัน ตามข้อมูลจากการทดลองทางคลินิกของไฟเซอร์ ผู้ป่วยหนึ่งในสามที่เคยรักษาด้วยยาอิมาตินิบเพียงอย่างเดียวประสบความสำเร็จในการบรรเทาอาการทางเซลล์พันธุศาสตร์ที่สำคัญ หลังจากรับประทานยาโบซูตินิบเป็นเวลา 24 สัปดาห์ (500 มก. วันละครั้ง) ในผู้ป่วยที่ได้รับยาอิมาตินิบและสารยับยั้งไทโรซีนไคเนสอีกตัวหนึ่ง (ดาซาตินิบ, สไพรเซล) พบว่า 27% ได้รับการบรรเทาอาการทางไซโตจีเนติกส์ที่สำคัญ อัตราการตอบสนองเพิ่มขึ้นอย่างต่อเนื่องในทั้งสองกลุ่มหลังจากใช้ยาดังกล่าวเป็นเวลา 24 สัปดาห์ขึ้นไป ไฟเซอร์กล่าว ไฟเซอร์ตั้งข้อสังเกตว่าเพียงร้อยละ 4 ของผู้ป่วยที่เป็นโรคเรื้อรังจะเข้าสู่ระยะลุกลามหรือเฉียบพลันหลังจากรับประทานยา Besutinib ผลข้างเคียงระดับ 3-4 ได้แก่ ภาวะเกล็ดเลือดต่ำ (26%), ภาวะนิวโทรพีเนีย (11%), ท้องร่วง (9%), โรคโลหิตจาง (9%) และผื่นที่ผิวหนัง (8%)
Bosutris (Bosutinib) bossutinib ได้รับการพัฒนาโดย Pfizer และได้รับการอนุมัติครั้งแรกในสหรัฐอเมริกาเมื่อเดือนกันยายน 2555 สำหรับการใช้งานในผู้ใหญ่ที่มีค่า Ph+CML ซึ่งมีประวัติดื้อยาหรือไม่สามารถทนต่อการรักษาในระยะเรื้อรัง ระยะเร่งด่วน หรือระยะเฉียบพลันได้ . BOSULIF เป็นยาจากไฟเซอร์ตัวแรกที่ใช้รักษาเนื้องอกทางโลหิตวิทยา และเป็นทางเลือกการรักษาที่สำคัญสำหรับผู้ป่วย Ph+CML ที่เคยดื้อยาหรือแพ้ยามาก่อน ข้อบ่งชี้ที่ขยายออกไปนี้มีศักยภาพที่จะส่งผลกระทบที่ยิ่งใหญ่ยิ่งขึ้นต่อชีวิตของผู้ป่วยมะเร็งเม็ดเลือดขาวชนิดเรื้อรังแบบไมอีลอยด์
เมื่อวันที่ 13 กรกฎาคม 2020 Mylan Pharmaceutical ของอินเดียได้เปิดตัว Bosutinib (Bosutinib/Bosutinib/Bosutinib) ยาชื่อสามัญทั่วไปในเชิงพาณิชย์ Bosutris เวอร์ชันทั่วไปของ Mylan มีราคาถูกกว่า Bosulif ดั้งเดิมของ Pfizer ประมาณ 25% (นอกจากนี้: Upjohn ซึ่งเป็นบริษัทยาชื่อสามัญของ Pfizer จะควบรวมกิจการกับ Mylan ในปีนี้เพื่อสร้าง Viatris ซึ่งเป็นบริษัทยาชื่อสามัญที่ใหญ่ที่สุดในโลก ซึ่งจะแล้วเสร็จในไตรมาสที่สี่ของปี 2020)




